Analyseurs
Le plateau cytométrie en flux est composé de deux analyseurs et d’un trieur de cellules.
Ces analyseurs permettent l’étude multiparamétrique d’éléments en suspension dans un flux (biotiques ou abiotiques). L’écosystème microbien aquatique est ainsi abordé à l’échelle de la cellule individuelle. Les abondances des différents groupes dits fonctionnels peuvent ainsi être déterminées (virus, bactéries, phytoplancton, flagellés hétérotrophes) grâce à la différenciation permise par la mesure des intensités de fluorescences pour chacune des cellules passant devant les lasers, et des diffusions lumineuses à 180° (FSC) et 90° (SSC) qui sont des indicateurs relatifs de tailles et de complexité interne des cellules. Les cellules en suspension, vivantes ou non, sont marquées par des fluorophores excitables aux longueurs d’ondes disponibles sur nos instruments (ex : bactéries hétérotrophes) ou autofluorescentes (ex : organismes photosynthétiques) et ainsi détectées sans marquage. Nous travaillons principalement sur la structure des communautés microbiennes planctoniques marines ou d’eaux douces ainsi que sur des cultures cellulaires.
Le FACS Canto 2, BD Biosciences

Le FACS Canto 2, BD Biosciences, est muni de trois lasers d’excitation à 405, 488 et 633 nm et de 8 canaux de récupération des photons émis. Ces 8 canaux récoltent les photons émis issus de l’excitation des fluorophores (induits ou naturels) et les transforment en électrons grâce à des photomultiplicateurs (PMT).
L'outil informatique sous windows XP dispose du logiciel d'analyse et traitements des données « Diva6 ».
Le Cytoflex, Beckman Coulter

Le Cytoflex, Beckman Coulter est muni lui aussi des 3 mêmes couleurs d’excitation et d’autant de canaux de récupération des photons émis. Il est par contre, en plus muni d’un SSC lié au laser violet dédié à l’étude des petites particules. Les détecteurs de cet instrument sont des photodiodes à avalanches (APD) plus sensibles et moins bruités que les PMTs.
L'outil informatique sous windows 7 dispose du logiciel d'analyse et traitements des données « CytExpert ».
Les appareils sont disponibles en service commun, la réservation se fait via la plateforme Open Iris.
Les applications en Océanographie :
La cytométrie en flux permet de comprendre la structure complexe des peuplements phytoplanctoniques, majoritairement constitués d'algues unicellulaires inférieures à 3 µm, et d'en suivre leurs évolutions saisonnières dans les écosystèmes aquatiques. Cette approche cellulaire des écosystèmes marins est à l'origine de l'évolution de la plupart des concepts développés en océanographie, particulièrement pour l'étude des cycles biogéochimiques dans les océans (cycle du carbone, de l'azote, interactions entre compartiments cellulaires vivants...).
La cytométrie en flux est aussi à l'origine de la découverte d'espèces nouvelles d'algues très abondantes et de très petites tailles (inférieure à 1µm), comme Prochlorococcus sp. (Chisholm et al. 1988) ou Ostreococcus tauri (Courties et al. 1994). Leur rôle primordial dans les chaînes trophiques océaniques est essentiellement étudié à l'aide de cytomètres en flux et trieurs de cellules, parfois embarqués sur des navires océaniques.
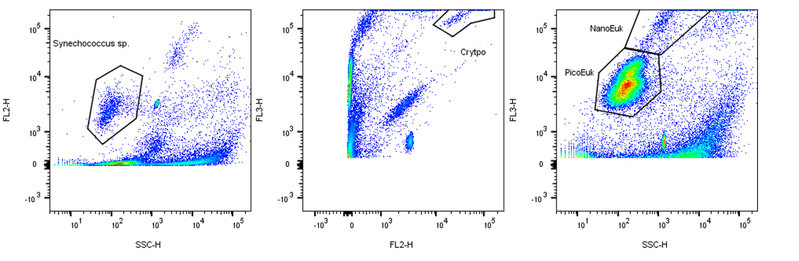 Workflow d’analyse du phytoplancton en milieu marin © David Pecqueur / OOB
Workflow d’analyse du phytoplancton en milieu marin © David Pecqueur / OOB
La plateforme BioPIC est notamment référente des analyses pico- et nanoplancton du réseau d’observation SOMLIT (INSU-CSOA) regroupant de plus en plus de stations d’observation (12 à ce jour). Nous collaborons aussi avec des universités nationales ou internationales et quelques sociétés privées sur des projets particuliers.
Le trieur de cellules

Le trieur de cellules est un AURORA CS (CYTEK) avec trois lasers de 405, 488 et 640 nm. Il est lui aussi muni d’APDs mais en comporte 38 permettant d’identifier précisément le spectre d’émission des populations détectées (ex : phytoplancton). Il permet de trier en tubes (1,5ml, 5ml, 15ml) avec de 2 à 6 voies de tri ou en plaques (24, 48 et 96 puits). Il permet notamment la purification de cultures contaminées ou encore l’isolement de groupes microbiens particuliers en vue d’analyses génétiques.
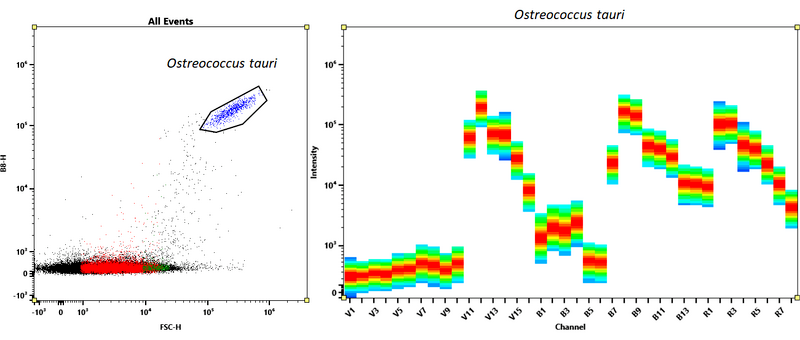 Spectre d'émission du modèle eucayote marin Ostreococcus tauri sur l'Aurora CS © David Pecqueur / OOB
Spectre d'émission du modèle eucayote marin Ostreococcus tauri sur l'Aurora CS © David Pecqueur / OOB
Application à la bactériologie marine :
Les bactéries marines, généralement très nombreuses (Ordre du million de cellules par millilitre), sont marquées par un intercalant des acides nucléïques (SybR Green I) les rendant fluorescentes, et permettant ainsi leur détection par nos instruments. On les différencie grâce à leurs propriétés de fluorescence et de diffusion lumineuse, ce qui permet en général de décrire la communauté bactérienne en 2 groupes : l'un faiblement fluorescent (Low Nucleic Acid LNA) et l'autre plus intensément fluorescent (High Nucleic Acid HNA), ces états reflétant des niveaux différents d'activités.
Le tri de fractions bactériennes, détectées sur la base des propriétés de diffusion des cellules (SSC) et de la fluorescence induite de leur acides nucléiques (Green fluorescence), que l'on associe à des analyses spécifiques du métabolisme ou de caractérisation en biologie moléculaire, permet de préciser l'activité de ces bactéries ainsi que leur diversité encore largement inconnue dans les écosystèmes aquatiques.











